Microbiota o Microbioma?
Spesso confondiamo questi due termini per un “difetto” nel loro utilizzo che abbiamo ereditato dalla lingua anglosassone. Infatti, questi termini nel gergo comune sono frequentemente usati in maniera intercambiabile. Tuttavia, pur facendo riferimento ad un argomento comune, esiste una piccola differenza tra i due. Vediamo insieme di cosa si tratta.
Microbiota
Il Microbiota rappresenta “l’insieme delle specie animali e vegetali che occupano un microambiente” (cit.Treccani – Cultura Italiana). Nel caso del nostro corpo esso rappresenta quindi l’insieme di microorganismi che vive in simbiosi con noi.
Microbioma
Sempre dal dizionario della lingua Italiana Treccani cercando la parola Microbioma possiamo leggere: “L’insieme dei microrganismi, dei loro genomi e delle interazioni ambientali che questi stabiliscono in un dato ambiente.”
Dunque, in questo caso si fa riferimento più nello specifico ai geni codificati dai microorganismi viventi in un determinato ambiente.
Più batteri che cellule? Non proprio
Dai dati disponibili in letteratura e dagli studi di microbiologia sappiamo che il nostro corpo a partire dalla cute per arrivare al nostro sistema gastro-intestinale sia colonizzato di cellule microbiche, per lo più batteriche, e la maggior parte di queste risiede nel nostro intestino. Data l’ampia superficie della mucosa di tale organo nel corso dei decenni scorsi era stato sovrastimato il numero di batteri presenti in tale sede, e quindi più in generale nel nostro corpo. Infatti, recentemente un gruppo di ricercatori israeliani (Ron Sender et al. 2016) ha revisionato il loro numero e il loro rapporto con le cellule umane (B:H), riportato solitamente come 10:1 o addirittura 100:1. Rivedendo i calcoli condotti in passato da altri ricercatori (T.Luckey 1972) tali studiosi hanno concluso che il reale rapporto B:H sia pari a 1-1,3, e quindi ben lontano dalle precedenti stime.
Questo, come anche ribadito dai ricercatori stessi, non deve assolutamente sminuire l’importanza o la dimensione del M.Intestinale che si costituisce comunque di svariati trilioni di cellule!
Caratteristiche ecologiche
Ognuno di noi si caratterizza per una flora microbica intestinale e corporea molto diversa dagli altri e non solo per motivi genetici.
Fin dalla nascita veniamo a contatto con queste forme cellulari estranee. Infatti, si è visto da numerosi studi come la tipologia di parto condizioni diversamente lo sviluppo del successivo Microbiota. Mentre per i bambini nati con parto per via naturale esso sarà principalmente influenzato dalla flora batterica presente nel canale del parto stesso, per i bambini nati da taglio cesareo il microbiota sarà più simile a quello della cute materna. Da lì in poi il microbiota si svilupperà con modifiche costanti fino a stabilizzarsi verso gli anni dell’adolescenza e poi nella successiva età adulta.
Abbiamo visto che la maggior parte di questi batteri che vive in simbiosi con le nostre cellule si trova nel nostro apparato digerente e, in particolare, la concentrazione più elevata la ritroviamo a livello del colon. Qui, a livello tassonomico vi sono 4 grandi tipi o phyla batteriche (ovvero raggruppamenti di famiglie e specie batteriche) chiamate Firmicutes, Bacteroidetes, Actinobacteria e Proteobacteria. Di esse i Firmicutes (Gram Positivi) e i Bacteroidetes (Gram Negativi) coprono circa il 90% delle forme presenti a livello intestinale. F.e B. sono anche i due phyla più studiati in ambito della patologia medica, specialmente nelle patologie metaboliche.
Le funzioni
Il M.Intestinale ricopre diverse e importanti funzioni all’interno del nostro organismo che si esplicano sia localmente che a distanza. Infatti, esso:
– forma una barriera protettiva sulle cellule dell’intestino per impedire, assieme allo strato mucoso, a forme patogene di penetrare all’interno del nostro corpo
– regola il corretto funzionamento delle giunzioni inter-cellulari e l’integrità della barriera impedendo la condizione di leaky gut, ovvero di aumentata permeabilità, molto pericolosa per il rischio di passaggio in circolo di tossine e forme microbiche patogene
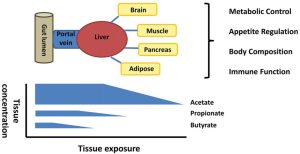
– sfrutta i nutrienti introdotti nel canale alimentare sia per la propria sopravvivenza sia per la produzione di energia aggiuntiva per l’organismo. In particolare, le cellule batteriche sfruttano i residui alimentari dei carboidrati non digeriti per produrre i cosiddetti “acidi grassi a corta catena” (SCFA – dall’inglese Short Chain Fatty Acids): acetato, propionato e butirrato. Queste sostanze sono utilizzate in parte come energia per il trofismo dei colociti (soprattutto il Butirrato) e in parte passano nel circolo sanguigno per poi essere utilizzati come molecole simil-ormonali a livello del fegato (soprattutto il Propionato) e degli altri organi periferici (sopratutto l’Acetato).
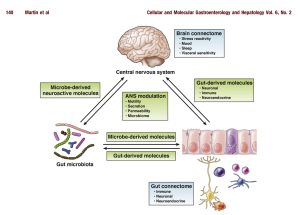
Inoltre, il Microbiota comunica con il sistema immunitario locale e con le cellule neuronali e neuroendocrine intestinali. In tal modo esso partecipa alla regolazione di vie nervose tramite il sistema nervoso simpatico (soprattutto tramite il Nervo Vago) fino a comunicare con il sistema nervoso centrale: ecco perché si parla di “asse intestino-cervello” e si fa spesso riferimento al M.intestinale come ad un “secondo cervello”: esiste una regolazione a doppio senso e una comunicazione costante tra i due sistemi, soprattutto per quanto riguarda i meccanismi di controllo di fame e sazietà, della motilità intestinale, e del metabolismo energetico in generale.
Infine, si ricorda che il Microbiota intestinale partecipa anche attivamente alla produzione di alcune vitamine (vit.gruppo B e K) e alla deconiugazione degli acidi biliari, contribuendo al ricircolo dei medesimi a livello entero-epatico.
Quindi: buono o cattivo?
Normalmente le cellule del microbiota intestinale convivono come detto prima con le nostre in maniera fisiologica: è un rapporto di simbiosi. Questo per lo meno fintanto che permane inalterato l’equilibrio che si instaura tra di esse.
Diete scorrette, stress, terapie antibiotiche, terapie mediche gastro- ed entero-lesive: sono alcuni dei principali fattori che possono influenzare il microbiota in maniera negativa alterando il delicato equilibrio presente nella flora batterica a favore di forme più aggressive e patogene.
Così facendo si alterano anche i meccanismi di controllo che regolano la permeabilità intestinale, come visto prima, facilitando il passaggio di materiale presente nel canale alimentare all’interno del circolo sistemico. La conseguenza di tutto ciò è l’instaurazione di uno stato infiammatorio cronico e di possibile endotossiemia che può determinare gravi squilibri metabolici e rischi per la salute.
Gli studi scientifici
Per facilità di analisi la maggior parte dei lavori scientifici presenti in letteratura sull’argomento sono studi condotti su modello animale, in particolar modo quello murino.
Da questi lavori e da successivi confronti condotti sull’uomo emerge come le alterazioni del microbiota, e in particolare del rapporto tra Firmicutes e Bacteroidetes, sia presente in molte patologie metaboliche. In alcuni casi è stato ipotizzato che tali perturbazioni siano anche causa o concausa nello sviluppo di malattie come Diabete Mellito di tipo 2, obesità, sindrome metabolica, patologie auto-immuni, ma anche patologie cardiovascolari, neoplasie e patologie infiammatorie intestinali. Inoltre, dato il legame tra la flora intestinale e il sistema nervoso, si è visto che la disbiosi può essere “causa” anche di malattie legate alla sfera psichica come la depressione o, addirittura, secondo alcuni autori l’autismo.
Le evidenze principali del fatto che sia proprio la flora microbica a creare tutti questi problemi derivano dal fatto che diversi studi hanno preso in considerazione il microbiota di topi con alterazioni metaboliche, come l’obesità, e topi sani. Oltre ad aver analizzato, sia sull’uomo che sull’animale, la differente flora batterica e aver visto una prevalenza di Firmicutes in queste patologie, si è visto che “sterilizzando” l’intestino di topi sani e ripopolandolo con il microbiota dei topi malati il “carattere” era trasmissibile: anch’essi nel tempo divenivano obesi o malati. Questa evidenza dipende da una diversa e aumentata capacità di alcune forme batteriche di accumulare energie e alterare i segnali di controllo relativi ai depositi di grasso, e in generale del senso di fame e sazietà visti in precedenza.
Parola d’ordine: dieta (sana!)
Secondo alcuni autori la dieta può spiegare fino al 57% delle variazioni del microbiota intestinale. Se pensiamo che durante il corso della nostra vita venivamo a contatto con germi patogeni e virulenti sul tratto gastro-enterico alcune volte all’anno, assumiamo terapie antibiotiche molto raramente, ma introduciamo del cibo nel canale alimentare circa 3-6 volte al dì è subito spiegato il perché di tale affermazione. Per quanto lo stress, le abitudini sregolate, i farmaci e tutti gli altri possibili fattori esterni possano avere un impatto negativo sulla composizione della flora microbica del nostro intestino dobbiamo prender consapevolezza del fatto che se la dieta di tutti i giorni fosse più sana e regolare ci sarebbero molte meno alterazioni in tal senso.
Tra i modelli annoverati come più sani e più indicati per regolarizzare il microbiota ritroviamo ancora una volta quello di tipo Mediterraneo. Infatti, la dieta Mediterranea si caratterizza per il basso consumo di alimenti pro-infiammatori, cibi elaborati e di origine animale, e un alto consumo di legumi, proteine vegetali, frutta, verdura (e quindi fibre per i nostri colociti e batteri) e alimenti ricchi in polifenoli come l’olio d’oliva. Tutto ciò che è industrialmente modificato o troppo elaborato sovraccarica il nostro sistema digestivo e crea situazioni infiammatorie che alterano la flora microbica; lo stesso vale per un eccesso di grassi, specialmente se di origine animale e trans.
Si è visto che seguendo tipologie di diete molto restrittive come quella vegetariana o vegana si generino differenze nelle specie batteriche del nostro Microbiota rispetto a quelle presenti nell’intestino di persone che seguono una dieta prevalentemente carnea. Allo stesso modo, la famosa “western-diet” occidentale determina alterazioni nei rapporti tra le forme batteriche più benefiche e quelle più patogene rispetto ad una dieta basata sul modello Mediterraneo.
Dunque, per poter creare e mantenere un buon microbiota intestinale il primo passo da fare è proprio quello di iniziare dalla tavola e arricchire la dieta di tutti i giorni di alimenti vegetali ricchi di fibre che aiutano la motilità intestinale e sono fonte di nutrimento per l’intestino così come è indispensabile una buona idratazione e il corretto apporto di grassi prevalentemente mono- e polinsaturi evitando il più possibile di consumare i classici junk food.
Quali altre strategie per modulare il Microbiota?
Oltre alla dieta e allo stile di vita salutare in senso lato, esistono altre possibilità di supporto per migliorare lo stato del M.intestinale.
Tra queste ricordiamo: probiotici, prebiotici, simbiotici, e il trapianto di microbiota fecale.
Partendo da quest’ultimo, il trapianto di m.fecale è una tecnica terapeutica riservata a forme particolarmente gravi di disbiosi non diversamente trattabili e quindi a casi selezionati, eseguita in centri medici altamente specializzati.
Per quanto riguarda le altre strategie citate è bene fare un pò di chiarezza con un estratto esplicativo direttamente estrapolato dal sito del Ministero della Salute:
“Il termine probiotico è riservato a quei microrganismi che si dimostrano in grado, una volta ingeriti in adeguate quantità, di esercitare funzioni benefiche per l’organismo.”
“Per alimenti/integratori con probiotici si intendono quegli alimenti che contengono, in numero sufficientemente elevato, microrganismi probiotici vivi e attivi, in grado di raggiungere l’intestino, moltiplicarsi ed esercitare un’azione di equilibrio sulla microflora intestinale mediante colonizzazione diretta. Si tratta quindi di alimenti in grado di promuovere e migliorare le funzioni di equilibrio fisiologico dell’organismo attraverso un insieme di effetti aggiuntivi rispetto alle normali attività nutrizionali.”
Tra i probiotici più utilizzati in ambito medico e negli studi scientifici ricordiamo il Lactobacillus rhamnosus e i Bifidobacteria, batteri capaci di regolarizzare e influenzare in maniera positiva il microbiota intestinale. Il L.rhamnosus in particolare è molto utilizzato nel trattamento di forme dismetaboliche in quanto ha dato prova di avere un effetto positivo sui profili glicemici e sui livelli di lipidi circolanti.
La definizione di prebiotico, invece, è riservata alle sostanze non digeribili di origine alimentare che, assunte in quantità adeguata, favoriscono selettivamente la crescita e l’attività di uno o più batteri già presenti nel tratto intestinale o assunti insieme al prebiotico.
“Con alimenti/integratori con prebiotici ci si riferisce a quegli alimenti che contengono in quantità adeguata, molecole prebiotiche in grado di promuovere lo sviluppo di gruppi batterici utili all’uomo.”
“Un alimento/integratore con simbiotico contiene sia probiotici che prebiotici.”
Dalle linee guida ministeriali per l’utilizzo di tale prodotti leggiamo ancora quanto segue.
In conclusione, non è facile muoversi nell’ampio mondo ormai molto commerciale che regola la produzione di tali prodotti, pertanto è bene affidarsi sempre al consiglio di un esperto in materia poiché i “fermenti lattici” non sono tutti uguali e non sono sempre adatti a tutte le patologie: come per altri presidi medici è giusto mirare la terapia a seconda delle necessità e in questo caso è necessario avere ben chiara la patologia di base per poter scegliere il ceppo o il formulato più adatto alla situazione.
____________________________________
Bibliografia essenziale:
– Revised estimates for the number of human and bacteria cells in the body. R.Sender et al.2016
– Treccani – dizionario della lingua Italiana
– Gut Microbes 3:3, 186-202; May/June 2012; © 2012 landes Bioscience
– GUT MICROBES. 2016, VOL. 7, NO. 3, 189–200. http://dx.doi.org/10.1080/19490976.2015.1134082
– Cell Mol Gastroenterol Hepatol 2018;6:133–148. https://doi.org/10.1016/j.jcmgh.2018.04.003
– An obesity-associated gut microbiome with increased capacity for energy harvest. P.J.Turnbaugh et al. TNATURE|Vol 444|21/28 December 2006
– Singh et al. J Transl Med (2017) 15:73
– http://www.salute.gov.it/portale/temi/p2_6.jsp?id=1426&area=Alimenti%20particolari%20e%20integratori&menu=integratori